Ковалентний хімічний зв’язок
Ковалентний зв’язок утворюється за рахунок спільних електронних пар.
Ковалентний зв'язок найчастіше виникає між атомами зі схожою високою електронегативністю. Ковалентний зв'язок найчастіше виникає між неметалами, тоді як іонний зв'язок є найпоширенішою формою зв'язку між атомами металів та неметалів.
Ковалентний зв'язок, як правило, сильніший ніж інші типи зв'язку, такі як іонний. Річ у тому, що на відміну від іонного зв'язку, в якому атоми утримуються ненаправленою кулонівською силою, ковалентні зв'язки є направленими. Наслідком є те, що молекули із ковалентним утриманням мають тенденцію формувати відносно невелику кількість характерних форм, демонструючи специфічні кути зв'язку.
Ковалентний зв'язок поділяється на ковалентний полярний і ковалентний неполярний.
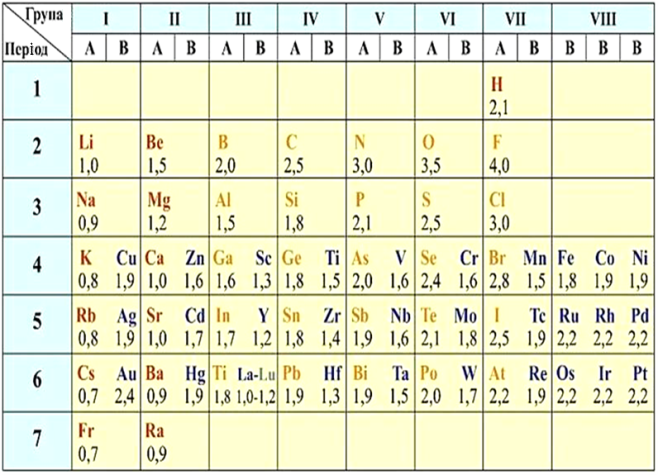
ВІДНОСНА ЕЛЕКТРОНЕГАТИВНІСТЬ ЕЛЕМЕНТІВ
Якщо спільні електронні пари розміщені точно посередині між атомами елементів, такий зв'зок називається ковалентним неполярним.
При взаємодії атомів з однаковою електронегативністю утворяться молекули з ковалентним неполярним зв'язком. Такий зв'язок існує в молекулах наступних простих речовин: H2, F2, Cl2, O2, N2. Хімічні зв'язки в цих газах утворені за допомогою спільних електронних пар, тобто при перекритті відповідних електронних хмар при зближенні атомів. Складаючи електронні формули речовин, потрібно пам'ятати, що кожна спільна електронна пара — це умовне зображення підвищеної електронної густини, що виникає внаслідок перекриття відповідних електронних хмар.
Якщо спільні електронні зміщені до атома з більшою електронегативністю, такий зв'зок називається ковалентним полярним.
При взаємодії атомів, значення електронегативностей яких відрізняються, але не різко, відбувається зміщення загальної електронної пари до більш електронегативного атома. Це найпоширеніший тип хімічного зв'язку, який зустрічається як в неорганічних, так і органічних сполуках. До ковалентних зв'язків повною мірою належать і ті зв'язки, які утворені по донорно-акцепторному механізму, наприклад в іонах гідроксонію і амонію. Ковалентний зв'язок є формою хімічного зв'язку, характерною особливістю якого є те, що задіяні атоми посідають одну чи більше спільних пар електронів що і спричиняють їх взаємне притяжіння що утримує їх у молекулі. Електрони при цьому, як правило, заповнюють зовнішні електронні оболонки задіяних атомів. Такий зв'язок завжди сильніший ніж міжмолекулярний зв'язок та порівняльний за силою чи сильніший за йонний зв'язок. Порівняємо полярність зв'язку у ряду гідроген галогенідів HF-HCl-HBr-HI. Флуор — найбільш електронегативний елемент, і він найбільше зміщує спільну електронну пару у свій бік. Тому у сполуці HF полярність зв'язку найбільша. У ряду F-Cl-Br-I електронегативність зменшується. У молекулі HCl полярність зв'язку менша, ніж у HF, але більша ніж в HBr і HI ковалентний зв'язок найменш полярний.
Як приклади речовин з ковалентним полярним типом зв'язку можна назвати гідроген фторид HF, вода H2O, амоніак NH3, метан CH4, карбон(IV) оксид CO2.