Йонний хімічний зв’язок
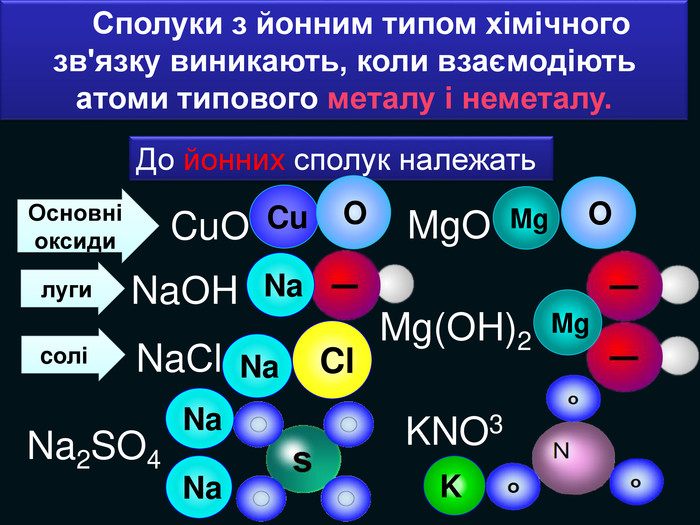
Цей тип зв'язку має електростатичну природу та утворюється між яскраво вираженими металами та неметалами. Іонний тип зв'язку реалізується при утворенні більшості солей, оксидів металів та гідроксидів металів і неметалів.
Іонні сполуки існують у вигляді кристалів, твердих за нормальних умов, а формули типу CsF, Na2O, Ca(OH)2 тощо відображають співвідношення іонів у кристалі.
Іонні сполуки мають високі (порівняно з ковалентними) температури плавлення та кипіння, добре розчинні у воді та інших полярних розчинниках, погано розчинні у бензолі, тетрахлорометані, ацетоні та інших неполярних розчинниках.
У твердому стані іонні сполуки не проводять електричний струм.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу є кам'яна сіль NaCl. Атоми Натрію і Хлору, з яких утворена дана сполука, різко відрізнається за електронегативністю: величина електронегативності атома Na — 1,01, атома СІ — 2,83. Електронні формули цих атомів відповідно: 1s22s22p63s1 і 1s22s22p63s23p5. З електронних формул видно, що ці атоми мають незавершені зовнішні електронні оболонки. Очевидно, що для атому Na, щоб досягти електронної конфігурації найближчого інертного газу, легше віддати 1 електрон ніж приєднати 7, а атому СІ легше приєднати 1 електрон, ніж віддати 7. Тому було встановлено, що при хімічній взаємодії атом Na віддає 1 електрон, а атом СІ приєднує його. Схематично це виглядає так:
Na—1e- = Na+
CI + 1e- = CI-
Між іонами Na+ і CI- виникають сили електростатичного притягання, в результаті чого утворюється сполука NaCI.
До йонних кристалів належать також численні оксиди (MgO).
На відміну від ковалентного, іонний зв'язок не є направленим, тому валентні кути в сполуках з іонними зв'язками можуть коливатися в широких межах. Йонні зв'язки не характеризуються властивістю насичення, а кулонівські сили, які в них відіграють основну роль, діють на далеких відстанях, спадаючи дуже повільно. Тому при розрахунках енергії взаємодії неможливо обмежитися найближчими сусідами атомів.
Усі йонні сполуки за звичайних умов є, як правило, кристалічними речовинами. Йони сполучаються один з одним досить міцно. Для того, щоб зруйнувати йонний, зв'язок необхідно затратити чималу енергію. При досягненні температури плавлення кристала іонні зв'язки руйнуються і кристал починає плавитись.