Електронні і графічні електронні формули атомів s-, p-, d-елементів |
1. Електронні формули атомів s-, p-, d-елементів
Кількість електронів в атомі дорівнює його порядковому номеру в періодичній системі. Електрони рухаються навколо ядра атома дотримуючись правил квантової механіки.
1. Електрони розподіляються по енергетичним рівням. Кількість енергетичних рівнів дорівнює номеру періоду.
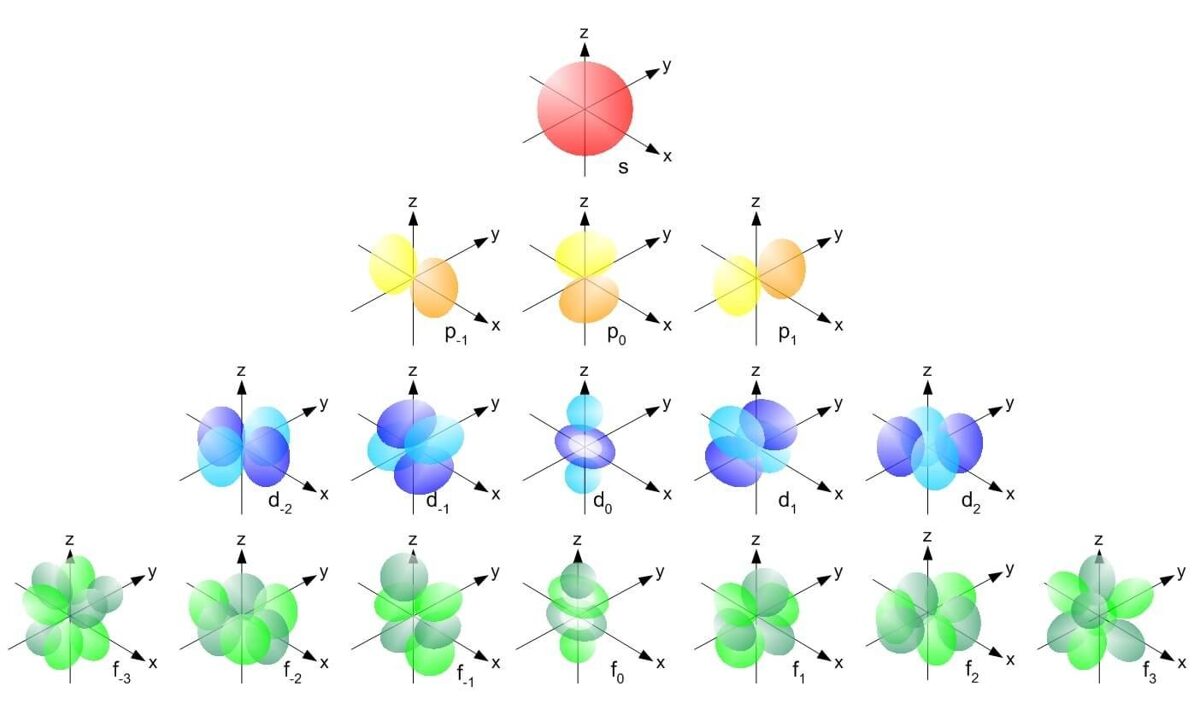
2. На кожному енергетичному рівні знаходяться електронні орбіталі. Орбіталь — це область простору, в якій ймовірність перебування електрона становить понад 90%. Типи електронних орбіталей: s — р — d — f . Кількість різних типів орбіталей дорівнює номеру періоду, проте поки що нам невідомі елементи, в яких електрони заповнюють наступну після f орбіталь. Орбіталі відрізняються формою, енергією, кількістю:
- s-орбіталь — одна, має сферичну форму і мінімальну енергію
- р-орбіталей — їх три, мають форму об'ємної вісімки
- d-орбіталей — п'ять
- f-орбіталей — сім.
Від s до f-орбіталі енергія зростає, форма стає більш складною.
3. На кожній орбіталі може розміщуватися два електрони з різними спінами. Спін - власний момент кількості руху електрона, можна уявити як обертання електрона навколо своєї осі за чи проти годинниковою стрілкою.
Для складання електронних і графічних формул елементів зручно використовувати періодичну систему.
Алгоритм складання електронних формул елементів
- Малюємо коло, яке символізує ядро атома, всередині записуємо заряд ядра атома — порядковий номер елемента зі знаком "плюс"
- Справа від ядра дужками позначаємо енергетичні рівні. Їх кількість дорівнює номеру періоду. Інакше кажучи, кожен період — це один енергетичний рівень
- Під кожним енергетичним рівнем записуємо кількість електронів на орбіталях різного типу. В періодичній системі вони позначені різним кольором:
- s-орбіталі — рожевим
- р-орбіталі — жовтим
- d-орбіталі — блакитним
- f-орбіталі — зеленим
4. Рахуємо кількість елементів кожного кольору і записуємо отримані числа в стовпчик під дужками, поки не дійдемо до кінця періоду, або до елемента, електронну формулу якого записуємо.
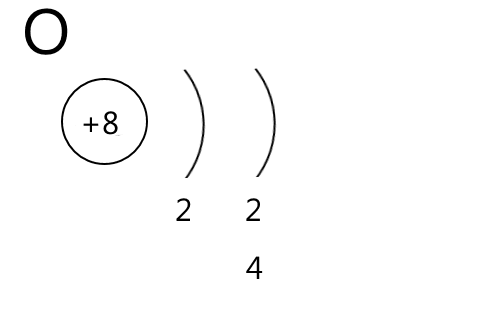
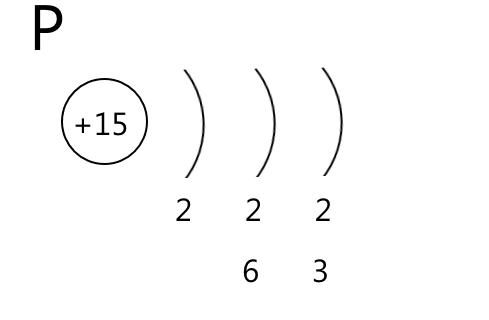
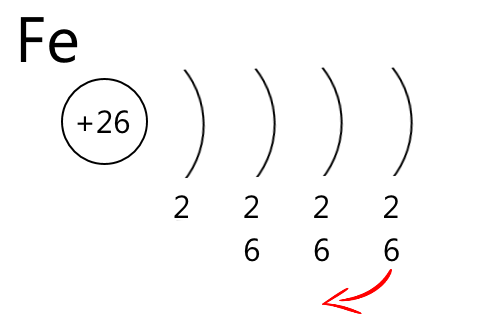
У результаті отримаємо приблизно такі схеми будови атомів, по яким зручно записувати електронні формули і розподіл електронів по орбіталям. Додаткових пояснень вимагає червона стрілочка у схемі будови атома Феруму. Шість d-електронів, які заповнюють орбіталі у елементів четвертого періоду, насправді є 3d-електронами, які розміщуються на третьому енергетичному рівні. Чому відбувається цей перехід електронів пояснює принцип мінімальної енергії.
2. Принцип мінімальної енергії
Електрони надзвичайно енергоекономні, інакше вони не зможуть існувати. В оточуючому світі панує ентропія, яка знищує кожен об'єкт, який не відповідає принципу мінімальної енергії. Зате ті об'єкти, які даному принципу відповідають, існують необмежено довго і їх вік може бути співставним із віком самого нашого Всесвіту.
Ці міркування формулюються у вигляді принципу мінімальної енергії — найбільш стабільному стану електрона в атомі відповідає стан із мінімальною можливою енергією.
Саме тому електрони послідовно заповнюють енергетичні рівні: 1 — 2 — 3 — 4... і електронні орбіталі: s — р — d — f . І якщо в атомі Феруму спочатку заповнюється 4s-орбіталь і тільки потім 3d, це означає, що енергія, необхідна для заповнення 4s-орбіталі, нижча, ніж для заповнення 3d-орбіталі.
Розрахувати порядок заповнення електронних орбіталей дозволяють два правила Клечковського:
1. Заповнення орбіталей відбувається по мірі зростання для них суми головного та орбітального квантових чисел (n+l )
Головне квантове число (n ) — це номер енергетичного рівня.
Орбітальне квантове число (l ) — це число, яке відповідає типу електронної орбіталі: s — 0; р — 1; d — 2; f — 3.
Для 4s-орбіталі сума головного та орбітального квантових чисел 4 + 0 = 4, для 3d-орбіталі — 3 + 2 = 5. Оскільки 4 < 5, електрони спочатку заповнюють 4s-орбіталь і тільки потім 3d.
2. Якщо сума головного та орбітального квантових чисел (n+l ) рівна, першою заповнюється орбіталь із меншим значенням головного квантового числа.
Для 3d і 4р-орбіталей суми головного та орбітального квантових чисел рівні: 3 + 2 = 5, 4 + 1 = 5. Але оскільки 3 < 4, електрони спочатку заповнюють 3d-орбіталь і тільки потім 4р.