Насичені одноатомні спирти
Спирти — похідні вуглеводнів, молекули яких містять одну або кілька гідроксильних груп.
Група атомів -ОН називається функціональною групою спиртів.
За кількістю гідроксогруп спирти поділяються на одно- та багатоатомні.
Загальна формула насичених одноатомних спиртів — СnH2n+1OH
3D-моделі молекул спиртів
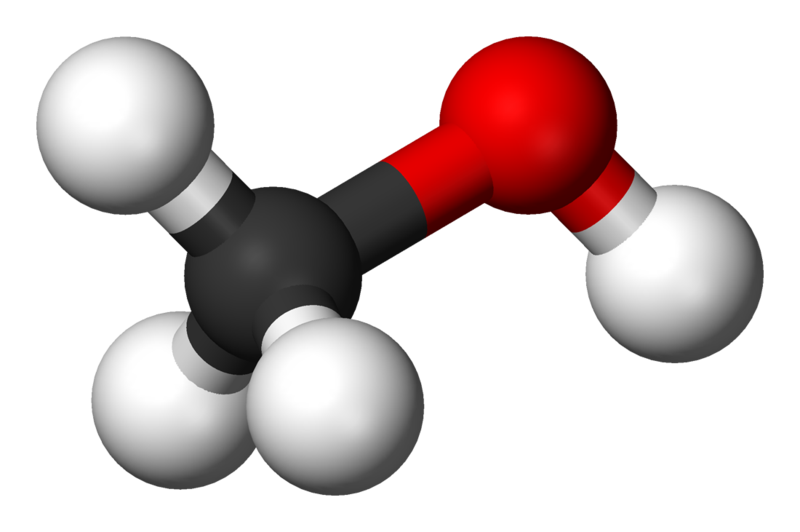
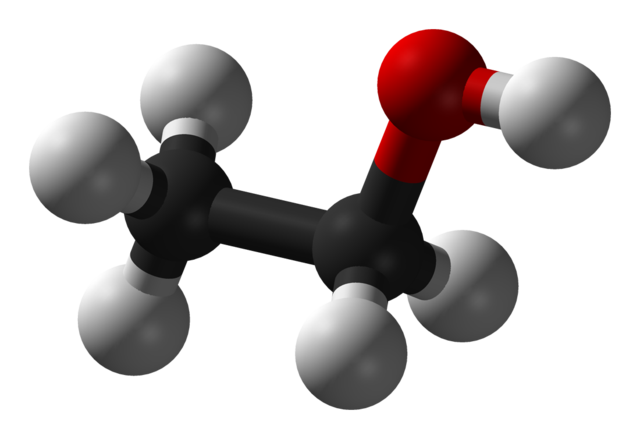
Номенклатура та ізомерія спиртів
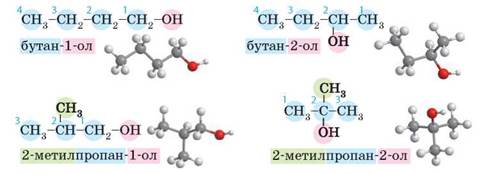
За міжнародною систематичною номенклатурою назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса -ол: етанол.
За раціональною номенклатурою назви спиртів утворюються від назв радикалів відповідних вуглеводнів з додаванням закінчення -овий спирт: етиловий спирт.
У метанолу і етанолу є також тривіальні назви. Метанол називають деревним спиртом, а етанол — винним або медичним.
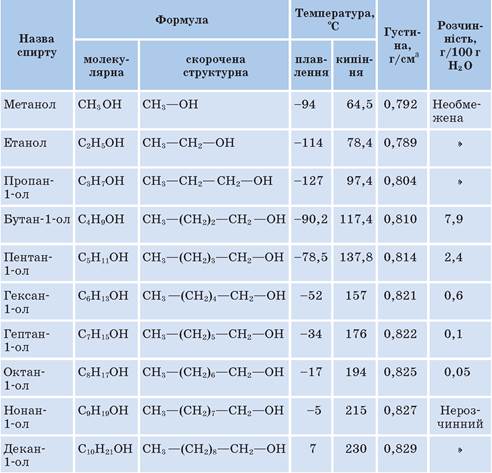

Фізичні властивості спиртів
Спирти з числом атомів Карбону до 15 — рідини, інші — тверді речовини.
Метанол і етанол — безбарвні рідини, з характерним запахом, добре розчинні у воді.
Температура кипіння метанолу 65 °С , етанолу 78 °С.
Хімічні властивості спиртів
1) Окиснення
а) Повне окиснення (горіння)
С2Н5ОН + 3О2 → 2СО2 + 3Н2О
б) часткове окиснення
С2Н5ОН + CuО → CH₃COH + Cu + Н2О
При частковому окисненні спиртів утворюються альдегіди. Етанол перетворюється на етаналь — оцтовий альдегід.
2) Реакція з лужними металами
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2
3. Реакція з галогеноводнями
С2Н5ОН + HBr → С2Н5Br+ H2О
4. Дегідратація
а) внутрішньомолекулярна дегідратація (температура вища за 100 °С у присутності концентрованої сульфатної кислоти, утворюються ненасичені вуглеводні)
С2Н5ОН → СН2=СН2 + H2О
б) міжмолекулярна дегідратація (надлишок спирту, температура нижча за 100 °С, утворюються прості ефіри)
2С2Н5ОН → С2Н5ОС2Н5 + H2О
5. Реакція естерифікації — взаємодія карбонових кислот і спиртів, у результаті якої утворюються естери (складні ефіри). При взаємодії оцтової кислоти та етилового спирту утворюється етилацетат:
CH₃COОH + С2Н5ОН → CH₃COОС2Н5 + Н2О
Застосування спиртів
Метанол
- розчинник
- одержання формальдегіду
- барвників
- фотореактивів
- фармацевтичних препаратів
Етанол
- отримання синтетичного каучуку
- пластмас
- діетилового естеру
- барвників
- оцтової кислоти
- розчинник при виготовленні парфумів, одеколонів, ліків, лаків і т. д.
- пальне для двигунів внутрішнього згоряння (у суміші з бензином)
- виготовлення алкогольних напоїв
- Фізіологічна дія спиртів
Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть.
Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм.