Ковалентні карбон-карбонові зв’язки у молекулах органічних сполук: простий, подвійний, потрійний
Вивчаючи хімію, ви ознайомилися з йонним, ковалентним, водневим зв’язком. В органічних сполуках реалізуються всі ці типи зв’язку. Найбільш поширеним є ковалентний зв’язок, оскільки майже всі органічні сполуки складаються з молекул, а в них атоми сполучені саме таким зв’язком.
Відомо, що ковалентний зв’язок виникає між двома атомами внаслідок утворення однієї або кількох спільних електронних пар за рахунок неспарених електронів. Формуванню таких пар передує перекривання відповідних орбіталей. Орбіталі можуть перекриватися з утворенням:
• однієї спільної ділянки, яку перетинає лінія, що з’єднує центри атомів;
• двох спільних ділянок, розміщених з протилежних боків від указаної лінії.
Утворення ковалентних зв’язків за участю атомів Карбону. В органічних речовинах атоми Карбону можуть сполучатися з іншими атомами простими, подвійними, потрійними зв’язками. У цих речовинах Карбон чотиривалентний.
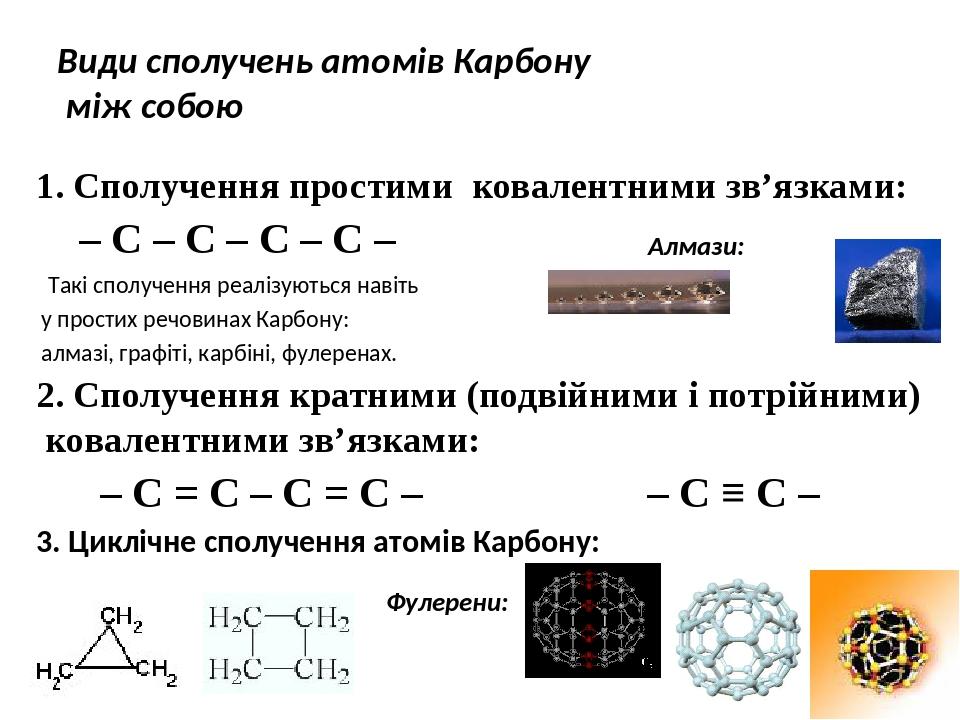
При утворенні такого зв’язку енергії 2s- і трьох 2р- електронів атома Карбону вирівнюються, а їхні орбіталі набувають однакової форми — несиметричної вісімки. Нові орбіталі орієнтуються одна відносно одної під кутами 109,5° й перекриваються з такими самими орбіталями іншого атома Карбону та/або із s-орбіталями атомів Гідрогену. Утворюються прості зв’язки1 С–С і С–Н. Простий зв’язок називають σ/зв’язком (σ читається «сигма»).
Молекули етену С2Н4 та його гомологів містять один подвійний зв’язок С=С. При утворенні такого зв’язку 2s-орбіталь і дві 2р-орбіталі кожного атома Карбону змінюють свої форми на однакову (теж несиметричної вісімки) й розміщуються під кутами 120°.
Отже, подвійний зв’язок С=С має два неоднакові складники, один із яких є простим зв’язком. Другий складник може легко руйнуватися під час хімічних реакцій.
Подібні зміни орбіталей атома Карбону, але лише двох (2s і 2р), відбуваються при утворенні потрійного зв’язку С≡С, який наявний у молекулах етину С2Н2 і його гомологів. Ці орбіталі, змінивши свої форми на однакову (несиметричної вісімки), орієнтуються під кутом 180°.
Кожний із цих складників поступається за міцністю простому зв’язку. Тому етин С2Н2 (НС≡СН) у відповідних хімічних реакціях перетворюється на насичені органічні сполуки. Таким чином, зв’язки С=С і С≡С утворені різними складниками.
Полярність зв’язку. Ця характеристика ковалентного зв’язку пов’язана з електронегативністю атомів. У другому випадку одна чи кілька спільних електронних пар зміщені до атома більш електронегативного елемента. Цей атом набуває часткового негативного заряду (δ–), а інший атом — часткового позитивного заряду (δ+). Напрямок зміщення електронної пари (або електронної густини) показують стрілкою:
Н Н
ǀ ǀ
С – СІ Н – С→СІ
ǀ ǀ
Н Н
Йонний зв’язок. Відомо, що йони із протилежними зарядами сполучаються один з одним. Так виникає йонний зв’язок. Він досить міцний. Органічних сполук, які складаються з йонів, дуже мало. Майже всі вони є солями. Серед них — солі карбонових кислот, амінокислот. Органічні сполуки, що мають йонну будову, — тверді речовини. Більшість їх розчиняється у воді.
Водневий зв’язок. Цей тип хімічного зв’язку реалізується між молекулами, в яких атоми Гідрогену сполучені з атомами найелектронегативніших елементів — Флуору, Оксигену, Нітрогену. Водневі зв’язки існують між молекулами води, спирту, оцтової кислоти, а також у водному розчині між молекулами води та молекулами будь-якої з названих сполук. Зв’язок цього типу бере участь у формуванні особливої будови молекул білків.