Класифікація вуглеводнів. Алкани
Вуглеводні — сполуки Карбону з Гідрогеном. Такі сполуки містяться в природному газі, нафті. Вони слугують паливом, пальним, сировиною в різних виробництвах. Вуглеводні становлять основу органічної хімії. Одне з означень цієї галузі хімічної науки таке: органічна хімія — хімія вуглеводнів та їх похідних. Похідними називають продукти заміщення атомів Гідрогену в молекулах вуглеводнів на атоми інших елементів або групи сполучених атомів (–ОН, –СООН, –NH2 та ін.).
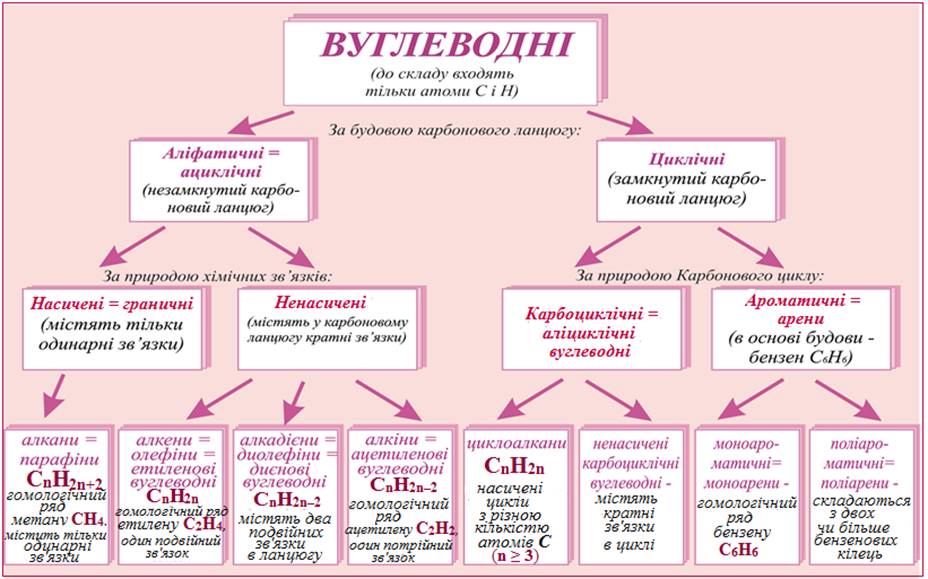
В основу класифікації вуглеводнів покладено будову карбонового ланцюга й наявність у їхніх молекулах простого чи кратного зв`язку між атомами Карбону. Карбоновий ланцюг може бути прямим, розгаложеним або циклічної форми, містити один або кілька кратних зв`язків.
Класифікація вуглеводнів
АЛКАНИ
Насичені вуглеводні, молекули яких мають відкритий карбоновий ланцюг, називають алканами.
Загальна формула алканів — СnH2n+2 (n = 1, 2, ...). У молекулах цих вуглеводнів усі атоми сполучені простим ковалентним зв’язком, а кути між лініями, що з’єднують центри сусідніх атомів, становлять 109,5°. Вуглеводні СН4, С2Н6, С3Н8 та інші аналогічні сполуки є гомологами й утворюють гомологічний ряд алканів.

Ізомерія
Відомо три алкани з формулою С5Н12, п’ять — із формулою С6Н14, дев’ять — із формулою С7Н16, а кількість ізомерів, які мають формулу С10Н22, сягає 75. Отже, зі збільшенням числа атомів Карбону в молекулах алканів кількість ізомерів істотно зростає. Молекули ізомерних алканів різняться за послідовністю сполучення атомів Карбону. Ці сполуки є структурними ізомерами і мають різні властивості. Наприклад, температура кипіння бутану з нерозгалуженими молекулами становить –0,5 °С, а його ізомеру з розгалуженими молекулами –11,7 °С. Існують відмінності й у хімічних властивостях ізомерів.
Номенклатура
Згідно із систематичною номенклатурою органічних сполук, назви всіх алканів мають суфікс -ан.
Якщо молекула має нерозгалужену («нормальну») будову, то перед назвою алкану часто записують літеру н із дефісом. Наприклад, сполуку з формулою СН3–СН2–СН2–СН3 називають н-бутаном.
При складанні назв ізомерів використовують поняття «замісник». Замісник — атом або група атомів, що є відгалуженням у карбоновому ланцюзі. Загальне позначення замісника — R. Якщо замісник утворений з атомів Карбону і Гідрогену, його називають вуглеводневим залишком. Формулу такого замісника можна отримати, «вилучивши» атом Гідрогену з формули вуглеводню. Назва замісника походить від назви вуглеводню і має суфікс -ил (-іл): метил СН3–, етил СН3–СН2–.
Правила складання назв алканів розгалуженої будови
1. У молекулі алкану обирають найдовший (головний) карбоновий ланцюг і нумерують у ньому атоми Карбону. Нумерацію починають із того кінця ланцюга, до якого ближче перебуває замісник (замісники).
2. Визначають назву кожного замісника.
3. Назви замісників розміщують за алфавітом на початку назви сполуки. Перед назвою кожного замісника через дефіс указують номер атома Карбону, з яким сполучений замісник. Останньою записують назву алкану нерозгалуженої будови, молекула якого містить стільки атомів Карбону, скільки їх у головному ланцюзі.
4. За наявності кількох однакових замісників зазначають їх кількість, додаючи до назви замісника префікс (ди- або ді- (відповідно до українського правопису), три-, тетра- тощо), а перед ним указують номери відповідних атомів Карбону, розділені комами.
Хімічні властивості
За н.у. алкани досить інертні:
- не реагують з лугами і кислотами;
- не окиснюються перманганат калію (KMnO₄);
- не знебарвлюють бромну воду (Вr₂).
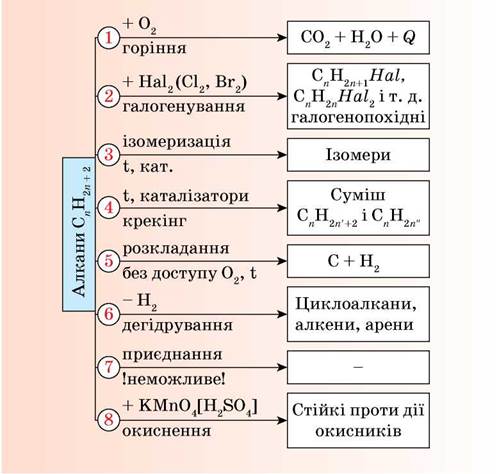
1. Горіння або повне окиснення
Суміш СН₄ і О₂ дуже вибухонебезпечна. Спричинює аварії в шахтах, може спричинити вибух в приміщенні.
2. Хлорування
Відбувається під дією світла. Атоми Гідрогену в молекулі метану послідовно заміщуються на атоми Хлору. При цьому утворюються хлорметан, дихлорметан, трихлорметан (хлороформ) та тетрахлорметан.
СН₄ + Cl₂ → CH₃Cl + HCl
CH₃Cl + Cl₂ → CH₂Cl₂+ HCl
CH₂Cl₂+ Cl₂ → CHCl₃+ HCl
CHCl₃ + Cl₂ → CCl₄+ HCl
Сумарне рівняння:
СН₄ + 4Cl₂ → CCl₄+ 4HCl
3. Крекінг або термічний розклад
СН₄ → С + 2Н₂
2СН₄ → С₂Н₂ + 3Н2
