Арени
Існує велика група сполук Карбону з Гідрогеном, назва якої доволі незвичайна — ароматичні вуглеводні. Вона пов’язана з тим, що раніше ці сполуки добували з природних духмяних смол. Проте спільна ознака таких сполук — не запах, а особлива будова молекул.
Ароматичні вуглеводні навколо нас
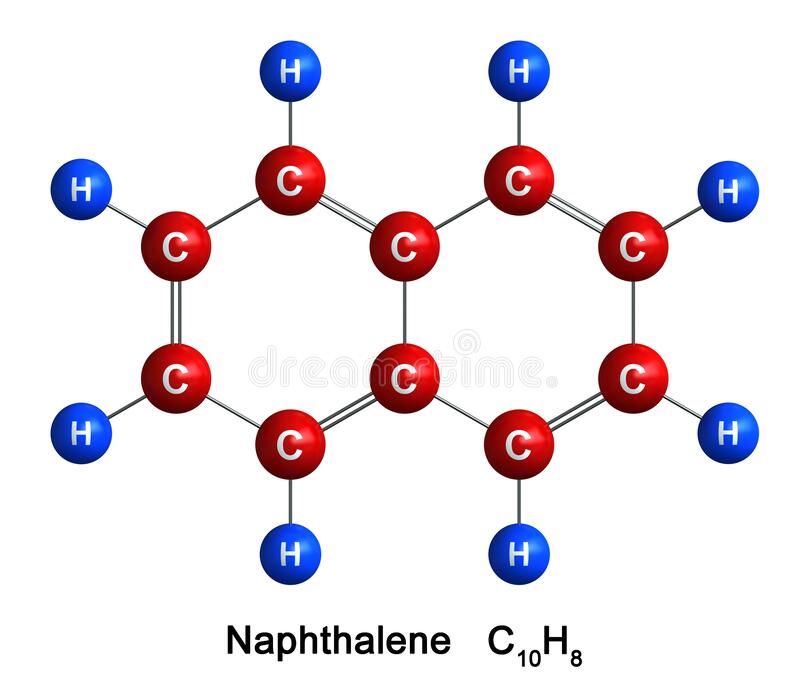
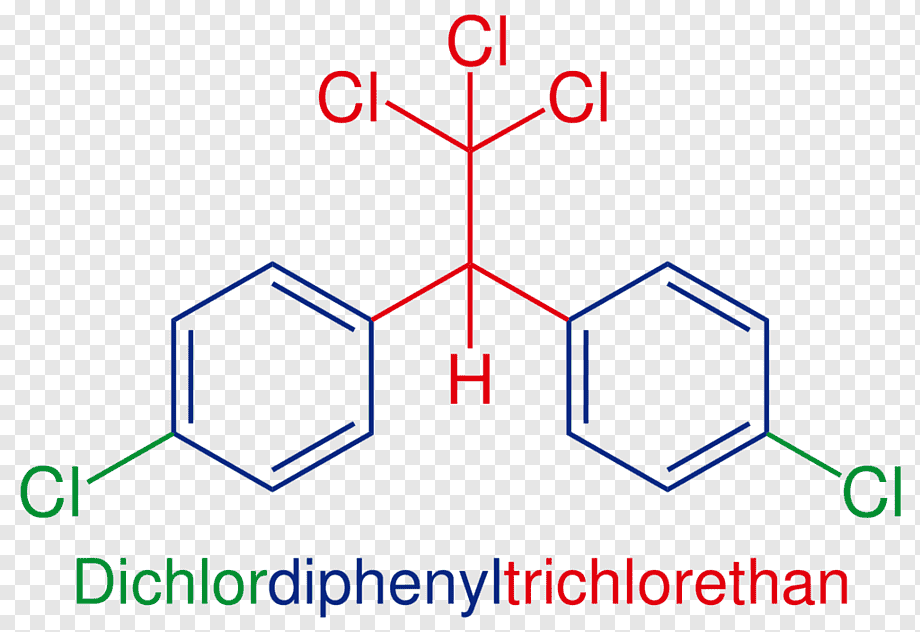
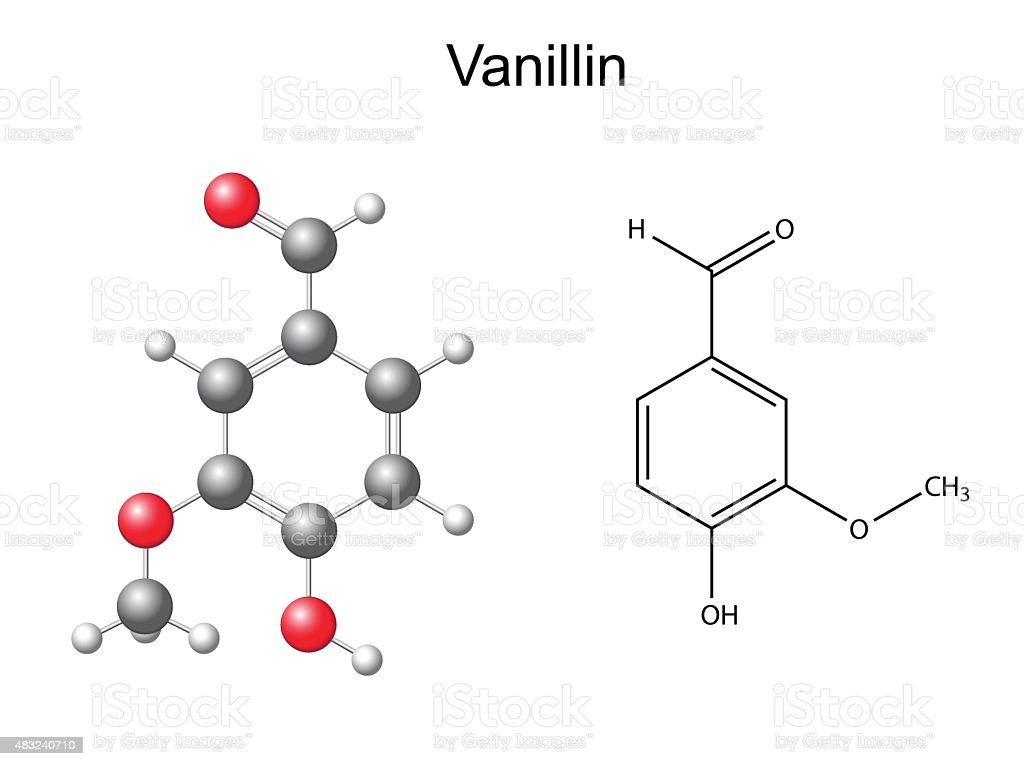
Поміркуйте, які ознаки спільні для цих речовин?
Відповідь:
1) усі вони мають запах — аромат, звідки й походить назва — "ароматичні вуглеводні";
2) усі вони токсичні (ванілін теж);
3) в їх молекулах є принаймні одне бензольне кільце.
Найпростіший представник ароматичних вуглеводнів — бензен — С6Н6.
Історія відкриття бензену
Уперше бензен описав німецький хімік Іоганн Глаубер у 1649 році Він отримав бензен з кам’яновугільної смоли.
Друге народження бензен отримав завдяки роботам Фарадея. У 1825 році Майкл Фарадей добув бензен з світильного газу.

Через 40 років після другого відкриття, у 1865 році, німецький хімік Фрідріх Август Кекуле встановив структуру молекули бензолу. Якось, після довгої роботи над підручником, Кекуле заснув, і йому приснилися атоми вуглецю і водню, зчеплені в нитки, які нагадували змій. Одна із змій вчепилася у власний хвіст, продовжуючи крутитися. Кекуле зчепив всі атоми Карбону в шестикутник, у якому чергуються подвійні і одинарні зв'язки.
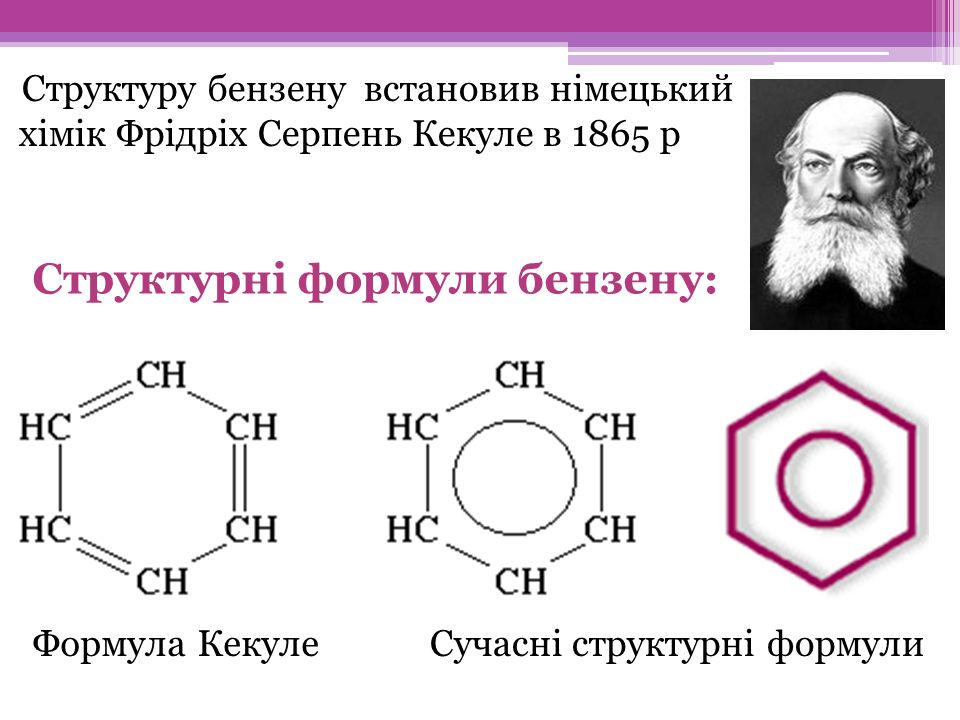
Будова молекули бензену
Фізичні властивості бензену
- рідина
- без кольору
- з характерним запахом
- нерозчинний у воді, сам є добрим розчинником
- легший за воду (ρ = 0, 88 г/см3)
- tпл = 5,5°С; tкип = 80°С
- токсичний. Вдихання парів бензену викликає головну біль, запаморочення
Хімічні властивості бензену
І. Окиснення
1) Горить
2С6Н6 + 15О2 → 12СО2 + 6Н2О
2) Стійкий до дії окисників, не знебарвлює розчин перманганату калію
ІІ. Реакції заміщення (подібно до насичених вуглеводнів)
1) Реакція з бромною водою (у присутності каталізатора FeCl3)
С6Н6 + Вr2 → С6Н5Вr + НВr
2) Нітрування бензену — реакція з нітратною кислотою у присутності концентрованої H2SO4
С6Н6 + HNO3 → С6Н5NO2 + Н2O
ІІІ. Реакції приєднання (подібно до ненасичених вуглеводнів)
1) Гідрогенування бензену — приєднання водню, утворюється циклогексан
С6Н6 + 3Н2 → С6Н12
2) Хлорування бензену — приєднання хлору, утворюється гексахлорциклогексан
С6Н6 + 3Сl2 → С6Н6Cl6
Застосування бензену та його похідних
1) отрутохімікати;
2) розчинники;
3) виготовлення вибухівки;
4) добавка до пального для підвищення його октанового числа;
5) в органічному синтезі для одержання барвників, полімерів, ліків.