Алкени
Вуглеводні, молекули яких мають відкритий карбоновий ланцюг з одним подвійним зв’язком, називають алкенами.
Загальна формула алкенів — СnH2n (n = 2, 3, ...).
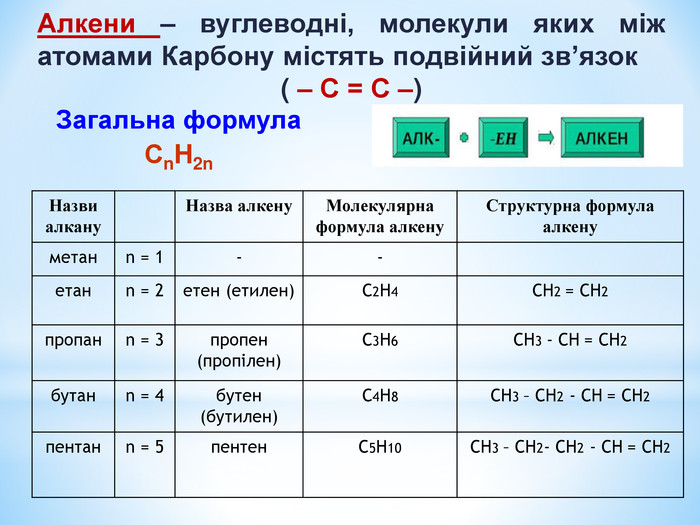
Назви.
Систематичні назви алкенів складають, дотримуючись такої самої послідовності, що і для алканів. Додатково враховують положення подвійного зв’язку в молекулі. Головний карбоновий ланцюг обирають так, щоб він містив цей зв’язок. Атоми Карбону нумерують від того кінця ланцюга, до якого подвійний зв’язок ближчий. Назву алкену з нерозгалуженими молекулами складають, додаючи суфікс -ен до кореня назви відповідного алкану з такою самою кількістю атомів Карбону в молекулі. Наприклад, алкен С3Н6 має назву пропен. Положення подвійного зв’язку в молекулах алкенів, крім етену і пропену, вказують у назві сполуки цифрою (найменшим номером відповідного атома Карбону) після кореня перед суфіксом -ен, причому до і після цифри записують дефіс: бут-1-ен.
Для алкенів із розгалуженими молекулами назви замісників та їх положення вказують у такий самий спосіб, що й для алканів.
Ізомерія.
Крім етену і пропену, всі інші алкени мають структурні ізомери. Ізомерні алкени можуть різнитися не лише будовою карбонового ланцюга (як і алкани), а й положенням подвійного зв’язку в ньому.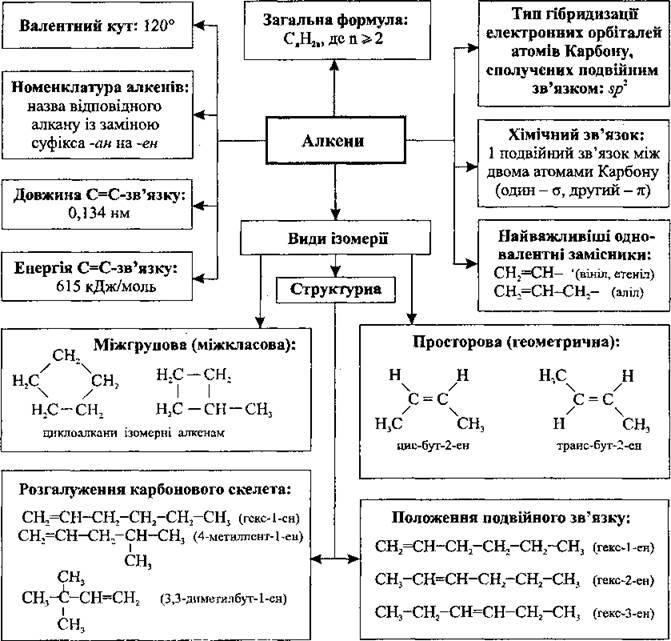
Фізичні властивості
Алкени за фізичними властивостями подібні до алканів. Етен, пропен і бутени за звичайних умов є газами, інші алкени — рідини або тверді речовини. Зі збільшенням відносної молекулярної маси сполук температури їх плавлення і кипіння зростають. Алкени нерозчинні у воді, але розчиняються в органічних розчинниках.
Хімічні властивості
Через наявність у молекулах алкенів подвійного зв’язку сполуки виявляють значну хімічну активність. У більшості реакцій за участю цих вуглеводнів подвійний зв’язок унаслідок розриву одного з його складників легко перетворюється на простий.
Реакції приєднання. Алкени сполучаються з воднем (реакція гідрування), галогенами (реакція галогенування), галогеноводнями, водою (реакція гідратації).
Бромування алкенів відбувається за участю не лише брому, а і його водного розчину — так званої бромної води (вона, як і бром, має бурий колір). Знебарвлення брому дає змогу відрізняти алкени та інші ненасичені сполуки від насичених. Це — одна з якісних реакцій на кратний зв’язок.

Добування
Ненасичені вуглеводні в природі не зустрічаються, через високу хімічну активність. У промисловості їх отримують крекінгом алканів, що входять до складу нафти та газу. Лабораторні способи отримання представлені у відео:
Застосування
Етилен прискорює дозрівання деяких плодів та овочів у теплицях. З етилену добувають поліетилен, етиловий спирт, хлоретан, який є анестезуючою речовиною, 1,2-дихлоретан — використовується як інсектицид для знищення шкідників с/г культур.