Карбонові кислоти
Поняття про карбонові кислоти
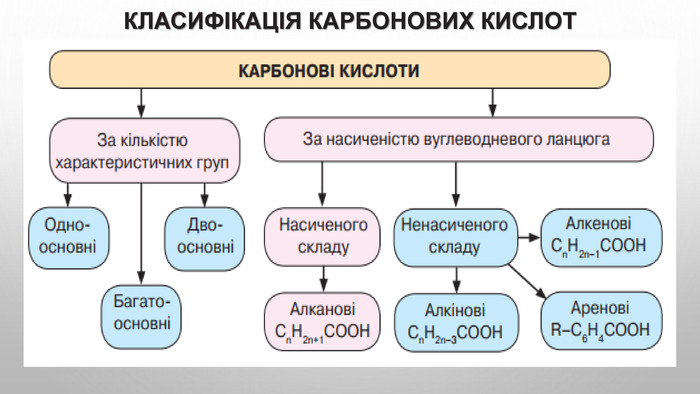
Карбонові кислоти — oрганічні речовини, молекули яких складаються з вуглеводневого радикала та карбоксильної групи -СООН.
Група -СООН називається функціональною групою карбонових кислот.
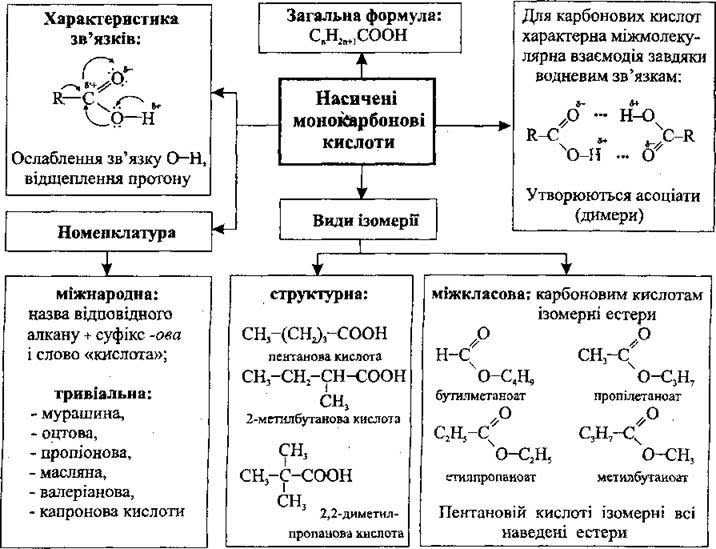
Загальна формула карбонових кислот RСООН, або СnH2n+1COOH
Назви карбонових кислот за систематичною номенклатурою утворилися від назв насичених вуглеводнів з додаванням закінчення –ова кислота. Тривіальні назви карбонових кислот склалися традиційно.
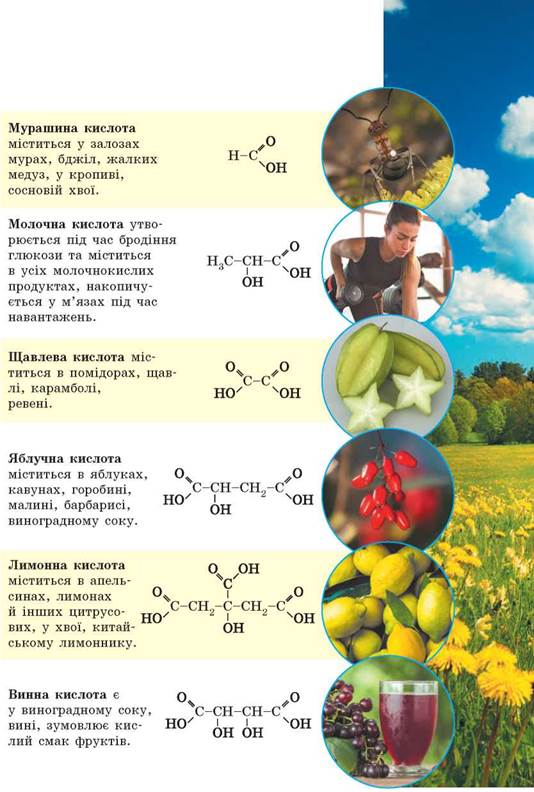
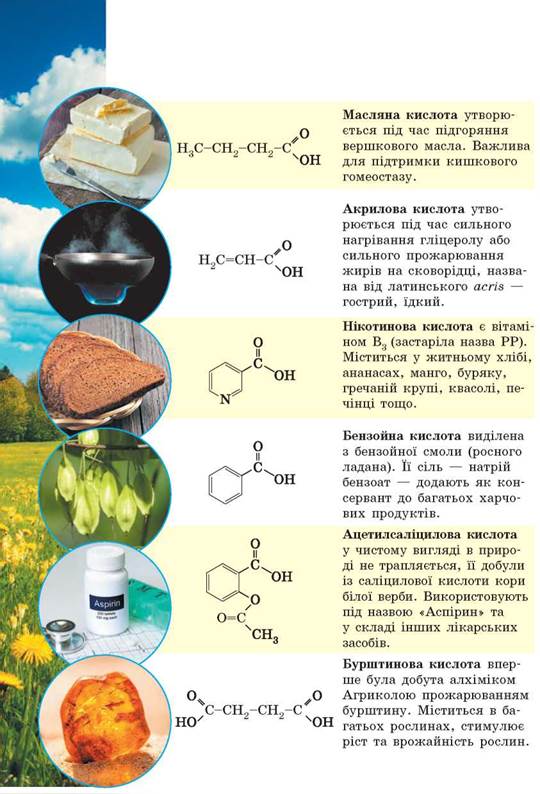
- HСООH – метанова кислота – мурашина
- СН3СООН – етанова кислота – оцтова
- С2Н5СООН – пропанова кислота – пропіонова
- С3Н7СООН – бутанова кислота – масляна
- С4Н9СООН – пентанова кислота – валеріанова
Фізичні властивості оцтової кислоти
- рідина, без кольору, з характерним запахом
- добре розчинна у воді
- має кислий смак
Хімічні властивості оцтової кислоти
1. Горить
СН3СООН + 2О2 → 2СО2 + 2Н2О
2. Дисоціює (розпадається на йони)
СН3СООН ↔ СН3СОО- + Н+
Ступінь дисоціації оцтової кислоти дуже низький: у розбавленому розчині розпадаються лише три молекули зі ста мільйонів.
3. Змінює забарвлення індикаторів
З дисоціацією пов'язана здатність оцтової кислоти змінювати забарвлення індикаторів, які реагують на наявність іонів Н+ у розчині.
4. Реакція з активними металами
2СН3СООН + Zn → (CН3СОО)2Zn + H2
5. Реакція з оксидами металів
2СН3СООН + CuО → (CН3СОО)2Cu + H2О
6. Реакція з основами
СН3СООН + NaOH → CН3СООNa + H2О
7. Реакція з солями
2СН3СООН + Na2СО3 → 2CН3СООNa + H2О + СО2
8. Реакція з спиртами, утворюються естери
СН3СООН + С2Н5ОН → 2CН3СООС2Н5 + H2О
9. Якісна реакція на ацетат-іон
3СН3СООNa + FeCl3 → (CН3СОО)3Fe + 3NaCl
Застосування оцтової кислоти